您现在的位置是: 首页 > 教育资讯 教育资讯
盐类水解高考汇编,盐类水解高考考点分析
tamoadmin 2024-07-18 人已围观
简介1.高考化学必考知识点2.Na2SO3(亚硫酸钠)溶液为什么显碱性? (出处:2012高考理综北京卷25题(3)3.高二化学盐的水解4.铵根离子的水解方程式5.高考在即,为了应付必须搞清楚这些请大家帮我,谢谢!6.盐类水解的问题。7.高二化学在高考中的考点有哪些?8.化学盐类的水解的离子浓度大小关系怎么比较?盐类水解常数可以由其酸或碱的电离常数和水的离子积推出。比如说醋酸根的水解常数可以写成这样:
1.高考化学必考知识点
2.Na2SO3(亚硫酸钠)溶液为什么显碱性? (出处:2012高考理综北京卷25题(3)
3.高二化学盐的水解
4.铵根离子的水解方程式
5.高考在即,为了应付必须搞清楚这些请大家帮我,谢谢!
6.盐类水解的问题。
7.高二化学在高考中的考点有哪些?
8.化学盐类的水解的离子浓度大小关系怎么比较?
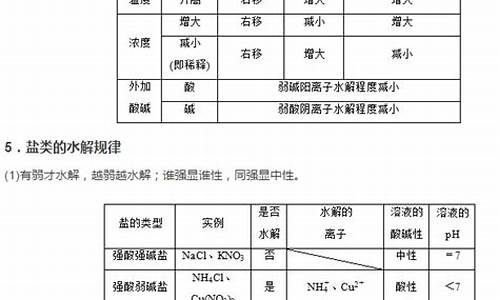
盐类水解常数可以由其酸或碱的电离常数和水的离子积推出。比如说醋酸根的水解常数可以写成这样:[HAC]x[OH-]/[AC-]x[H2O]这个你应该是知道的吧,由水解方程推出。又因为醋酸分子和水分子可以无视(常数的计算都是由离子决定的,而且纯水没有浓度)所以可以写成[OH-]/[AC-]这样分子就是水的离子积的一部分,分母就是醋酸电离的一部分,所以可以推出水解常数=Kw/Ki(电离),这里要注意多元酸根的分布电离,这个有点难,高考不会去考
高考化学必考知识点
| B |
| 试题分析:明矾常用于净水是因为明矾中含的铝离子发生了水解,氯化铁中由于铁离子的水解,形成了胶体所以其也可以用于净水,故A不能选;实验室制氢气时加CuSO 4 可加快反应速率,是因为形成了原电池,故加快了化学反应速率,故B正确,为本题的答案;实验室配制FeCl 3 溶液时加入少量稀盐酸,加入盐酸可以抑制铁离子的水解,故C不能选;实验室通常使用热的纯碱溶液去除油污,是因为纯碱是强碱弱酸盐,由于其水解,呈现碱性,所以可以除去油污,故D?不能选。 点评:本题考查了盐类水解,该考点是高考考查的重点和难点,本题侧重于考查该知识点的运用,该题难度中等。 |
Na2SO3(亚硫酸钠)溶液为什么显碱性? (出处:2012高考理综北京卷25题(3)
对于高考的化学来说,有哪些常考的知识点呢?掌握这些必考的基础知识点对于化学成绩的提升非常有帮助,我为大家整理了一些必考的化学知识点。
高考化学常考知识点总结
一、氧化还原相关概念和应用
(1)借用熟悉的H2还原CuO来认识5对相应概念
(2)氧化性、还原性的相互比较
(3)氧化还原方程式的书写及配平
(4)同种元素变价的氧化还原反应(歧化、归中反应)
(5)一些特殊价态的微粒如H、Cu、Cl、Fe、S2O32–的氧化还原反应
(6)电化学中的氧化还原反应
二、物质结构、元素周期表的认识
(1)主族元素的阴离子、阳离子、核外电子排布
(2)同周期、同主族原子的半径大小比较
(3)电子式的正确书写、化学键的形成过程、化学键、分子结构和晶体结构
(4)能画出短周期元素周期表的草表,理解“位—构—性”。
三、熟悉阿伏加德罗常数NA常考查的微粒数止中固体、得失电子、中子数等内容。
四、热化学方程式的正确表达(状态、计量数、能量关系)
化学如何学习?史上最强高考励志书《高考蝶变》教你怎样提高成绩,淘宝搜索《高考蝶变》购买。
五、离子的鉴别、离子共存
(1)离子因结合生成沉淀、气体、难电离的弱电解质面不能大量共存
(2)因相互发生氧化还原而不能大量共存
(3)因双水解、生成络合物而不能大量共存
(4)弱酸的酸式酸根离子不能与强酸、强碱大量共存
(5)题设中的其它条件:“酸碱性、颜色”等
六、溶液浓度、离子浓度的比较及计算
(1)善用微粒的守恒判断(电荷守衡、物料守衡、质子守衡)
(2)电荷守恒中的多价态离子处理
七、pH值的计算
(1)遵循定义(公式)规范自己的计算过程
(2)理清题设所问的是“离子”还是“溶液”的浓度
(3)酸过量或碱过量时pH的计算(酸时以H+浓度计算,碱时以OH–计算再换算)
八、化学反应速率、化学平衡
(1)能计算反应速率、理解各物质计量数与反应速率的关系
(2)理顺“反应速率”的“改变”与“平衡移动”的“辩证关系”
(3)遵循反应方程式规范自己的“化学平衡”相关计算过程
(4)利用等效平衡”观点来解题
九、电化学
(1)能正确表明“原电池、电解池、电镀池”及变形装置的电极位置
(2)能写出各电极的电极反应方程式。
(3)了解常见离子的电化学放电顺序。
(4)能准确利用“得失电子守恒”原则计算电化学中的定量关系
十、盐类的水解
(1)盐类能发生水解的原因。
(2)不同类型之盐类发生水解的后果(酸碱性、浓度大小等)。
(3)盐类水解的应用或防止(胶体、水净化、溶液制备)。
(4)对能发生水解的盐类溶液加热蒸干、灼烧的后果。
(5)能发生完全双水解的离子反应方程式。
十一、C、N、O、S、Cl、P、Na、Mg、A1、Fe等元素的单质及化合物
(1)容易在无机推断题中出现,注意上述元素的特征反应
(2)注意N中的硝酸与物质的反应,其体现的酸性、氧化性“两作为”是考查的的重点
(3)有关Al的化合物中则熟悉其反应(定性、定量关系)。
(4)有关Fe的化合物则理解Fe2+和Fe3+之间的转化、Fe3+的强氧化性。
(5)物质间三角转化关系。
十二、有机物的聚合及单体的推断
(1)根据高分子的链节特点准确判断加聚反应或缩聚反应归属
(2)熟悉含C=C双键物质的加聚反应或缩聚反应归属
(3)熟悉含(—COOH、—OH)、(—COOH、—NH2)之间的缩聚反应
十三、同分异构体的书写
(1)请按官能团的位置异构、类别异构和条件限制异构顺序一个不漏的找齐
(2)本内容最应该做的是作答后,能主动进行一定的检验
十四、有机物的燃烧
(1)能写出有机物燃烧的通式
(2)燃烧最可能获得的是C和H关系
十五、完成有机反应的化学方程式
(1)有机代表物的相互衍变,往往要求完成相互转化的方程式
(2)注意方程式中要求表示物质的结构简式、表明反应条件、配平方程式
十六、有机物化学推断的解答(“乙烯辐射一大片,醇醛酸酯一条线”)
(1)一般出现以醇为中心,酯为结尾的推断关系,所以复习时就熟悉有关“醇”和“酯”的性质反应(包括一些含其他官能团的醇类和酯)。
(2)反应条件体现了有机化学的特点,请同学们回顾有机化学的一般条件,从中归纳相应信息,可作为一推断有机反应的有利证据。
(3)从物质发生反应前后的官能差别,推导相关物质的结构。
十七、化学实验装置与基本操作
(1)常见物质的分离、提纯和鉴别。
(2)常见气体的制备方法。
(3)实验设计和实验评价。
十八、化学计算
(1)近年来,混合物的计算所占的比例很大(90%),务必熟悉有关混合物计算的一般方式(含讨论的切入点),注意单位与计算的规范。
(2)回顾近几次的综合考试,感受“守恒法“在计算题中的暗示和具体计算时的优势。
化学计算中的巧妙方法小结
得失电子守恒法、元素守恒法、电荷守恒法、最终溶质法、极值法、设验证法等。
高中化学必备口诀大全制氧气口诀:
二氧化锰氯酸钾;混和均匀把热加。
制氧装置有特点;底高口低略倾斜。
化学集气口诀:
与水作用用排气法;根据密度定上下。
不溶微溶排水法;所得气体纯度大。
电解水口诀:
正氧体小能助燃;负氢体大能燃烧。
化合价口诀:
常见化学元素的主要化合价
氟氯溴碘负一价;正一氢银与钾钠。
氧的负二先记清;正二镁钙钡和锌。
正三是铝正四硅;下面再把变价归。
全部金属是正价;一二铜来二三铁。
锰正二四与六七;碳的二四要牢记。
非金属负主正不齐;氯的负一正一五七。
氮磷负三与正五;不同磷三氮二四。
硫有负二正四六;边记边用就会熟。
高二化学盐的水解
涉及到盐类的水解
它是强碱弱酸盐,呈碱性。
原因是:弱电解质亚硫酸根的生成,破坏了水的电离,促进水的电离平衡发生移动的过程。
亚硫酸根水解与氢离子结合成为亚硫酸氢根,亚硫酸氢根在进一步与氢离子结合成亚硫酸(此步比上步的程度小)导致水中氢氧根离子浓度增大,呈现碱性。
你可能会问,亚硫酸根不是会电离出氢离子吗?
哇咔咔~事实是次反应过程中水解的影响大于电离的影响。所以总的是显碱性~
具体可参照百度百科“盐类水解”
说的啰嗦了些,没太懂的欢迎追问(*^__^*)
铵根离子的水解方程式
说明:无法输入“可逆号”,用→代替。
为了简化,醋酸根记作Ac-
----------------------
无论NaAc溶液还是NaF溶液,都有下列三式变化:
(1)盐的电离:NaX = Na+ + X-
(2)酸根水解:X- + H2O → HX + OH-
(3)水的电离:H2O → H + + OH-
我们发现,(2)式中X-(酸根)的减少量=OH-的增加量,
也就是说,虽然X-的水解程度不同,但光就水解这一步看,并不影响阴离子浓度的变化。
----------------------
但是:
(3)式却有不同,X-水解越厉害,溶液中OH-越多,则H+越少,
即,从定量计算看,(3)式中提供的OH-越少!!!
---------------------
结论
HF酸性>醋酸,因此NaAc比NaF水解剧烈,则阴离子总浓度更小。
---------------------
高考在即,为了应付必须搞清楚这些请大家帮我,谢谢!
水解方程式如下图:
水解是一种化工单元过程,是利用水将物质分解形成新的物质的过程。通常是指盐类的水解平衡。
盐类的水解就是指盐中的弱碱阳离子或者酸根离子与水电离产生的氢离子或者氢氧根离子结合,生成弱电解质的过程。
扩展资料鉴定方式
碱性溶液中的(奈斯勒试剂或称铵态氮试剂)是鉴定铵根离子的特效试剂。
在试液中加入少量氢氧化钾,然后煮沸,将沾有奈斯勒试剂的滤纸放在试管口检测逸出气体中是否有氨气。
如果没有干扰离子可以直接往试液中加入奈斯勒试剂检验。
奈氏试剂检验铵离子的主要反应式为:
2HgI42-+NH4++4OH-=[Hg2NH2O]I(红)+7I-+3H2O
作用后产生**或棕色(高浓度时)沉淀。
盐类水解的问题。
人教版高二化学 P62
关联网址:://.xfjy.cn/jxlw/gzja/gehxja/200508/7774.html
盐类水解的程度的大小,主要由盐本身的性质决定,但当到达平衡时和其他平衡一样,受温度、浓度等条件的影响,盐的水解规律是:溶液越稀越水解,温度越高越水解,盐越弱越水解
1.抑制电离
例如:实验室配制FeCl3溶液时,由于FeCl3是强酸弱碱生成的盐,可以水解生成难溶的Fe(OH)3
Fe3+ + 3H2O = Fe(OH)3 + 3H+
使溶液浑浊,因此在配制FeCl3时如果加入一定量的盐酸,就可使平衡向逆方向移动从而抑制水解
2.促进水解
例如:KCl溶液中混有FeCl3可以用加热的方法促使Fe3+水解生成Fe(OH)3沉淀而除去
3.双水解
当弱酸的酸酸根与弱碱的阳离子同时存在于水溶液中时,弱酸的酸根水解生成的氢氧根离子与弱碱的阳离子水解生成的氢离子反应生成水而使两种离子的水解平衡向水解方向移动而互相促进水解,而水解完全。
例如:泡沫灭火器中的主要化学物质是碳酸氢钠与硫酸铝,互相促进水解生成二氧化碳气体和氢氧化铝沉淀,从而产生大量的泡沫。
3HCO3- + Al3+ +3H2O = 3CO2 + Al(OH)3
我只能说这么多了...希望对你有帮助...
高二化学在高考中的考点有哪些?
问了这么多……==!
1,既然是水解方程,那么肯定是阴阳离子都存在,所以水里有H+,因而Fe(OH)3不能写沉淀符号了。你仔细看题目,是在沸水中完全反应,得到胶体,写可逆符号表示一直在反应,没有停止。
2,胶体两个字必须注明
最后这个问题是酸碱性排名的问题,你去查一下他们的强度就知道了
化学提高的话可以相当的快,靠的什么?靠记忆,其实这门课是理科里面要记忆的东西最多的一门,当然有些设计题还是要靠理论基础的,108分如果想得到80分以上,那些细碎的知识点一定要牢记,反复地记,反复地做题,不要怕出错,错了再做题,再记,这样坚持一个月,你就会发现化学也不过如此。
化学盐类的水解的离子浓度大小关系怎么比较?
高二上学期:选修五——有机化学基础
考点:1、基本官能团的认知、性质、判定、转化。
3、同分异构体的书写
2、有机化学推断综合
在高考中所占分值约:15分
高二下学期:选修四——化学反应原理
考点:1、热化学方程式
2、反应速率的计算
3、化学平衡移动
4、盐类水解
5、原电池与电解池原理
在高考中,选修四考点繁多,且较难,所占分值很大,约:30分
以上所列,为重点考点,细节还有许多,应以上面列举为参考,综合个人成绩实际情况,同时关注当年考纲变化。
电解质溶液中离子浓度大小比较问题,是高考的“热点”之一.高考化学试卷年年涉及这种题型.这种题型考查的知识点多,灵活性、综合性较强,有较好的区分度,它能有效地测试出学生对强弱电解质、电离平衡、电离度、水的电离、pH值、离子反应、盐类水解等基本概念的掌握程度及对这些知识的综合运用能力.处理此类试题时要关注以下几个方面.
必备相关知识
一、电离平衡理论和水解平衡理论
1.电离理论:
⑴弱电解质的电离是微弱的,电离消耗的电解质及产生的微粒都是少量的,同时注意考虑水的电离的存在;例如NH3·H2O溶液中微粒浓度大小关系.
分析由于在NH3·H2O溶液中存在下列电离平衡:NH3·H2ONH4++OH-,H2OH++OH-,所以溶液中微粒浓度关系为:c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+).
⑵多元弱酸的电离是分步的,主要以第一步电离为主;例如H2S溶液中微粒浓度大小关系.
分析由于H2S溶液中存在下列平衡:H2SHS-+H+,HS-S2-+H+,H2OH++OH-,所以溶液中微粒浓度关系为:c(H2S )>c(H+)>c(HS-)>c(OH-).
2.水解理论:
⑴弱酸的阴离子和弱碱的阳离子因水解而损耗;如NaHCO3溶液中有:c(Na+)>c(HCO3-).
⑵弱酸的阴离子和弱碱的阳离子的水解是微量的(双水解除外),因此水解生成的弱电解质及产生H+的(或OH-)也是微量,但由于水的电离平衡和盐类水解平衡的存在,所以水解后的酸性溶液中c(H+)(或碱性溶液中的c(OH-))总是大于水解产生的弱电解质的浓度;例如(NH4)2SO4溶液中微粒浓度关系.
分析因溶液中存在下列关系:(NH4)2SO4=2NH4++SO42-,
+
2H2O2OH-+2H+,
2NH3·H2O,由于水电离产生的c(H+)水=c(OH-)水,而水电离产生的一部分OH-与NH4+结合产生NH3·H2O,另一部分OH-仍存在于溶液中,所以溶液中微粒浓度关系为:c(NH4+)>c(SO42-)>c(H+)>c(NH3·H2O)>c(OH-).
⑶一般来说“谁弱谁水解,谁强显谁性”,如水解呈酸性的溶液中c(H+)>c(OH-),水解呈碱性的溶液中c(OH-)>c(H+);
⑷多元弱酸的酸根离子的水解是分步进行的,主要以第一步水解为主.例如Na2CO3溶液中微粒浓度关系.
分析因碳酸钠溶液水解平衡为:CO32-+H2OHCO3-+OH-,H2O+HCO3-H2CO3+OH-,所以溶液中部分微粒浓度的关系为:c(CO32-)>c(HCO3-).
二、电荷守恒和物料守恒
1.电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等.如NaHCO3溶液中:n(Na+)+n(H+)=n(HCO3-)+2n(CO32-)+n(OH-)推出:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
2.物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的.如NaHCO3溶液中n(Na+):n(c)=1:1,推出:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
注意书写电荷守恒式必须①准确的判断溶液中离子的种类;②弄清离子浓度和电荷浓度的关系.
3.导出式——质子守恒:如碳酸钠溶液中由电荷守恒和物料守恒将Na+离子消掉可得:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3).此关系式也可以按下列方法进行分析,由于指定溶液中氢原子的物质的量为定值,所以无论溶液中结合氢离子还是失去氢离子,但氢原子总数始终为定值,也就是说结合的氢离子的量和失去氢离子的量相等.可以用图示分析如下









