您现在的位置是: 首页 > 教育资讯 教育资讯
原电池电解池高考题难,原电池和电解池高考
tamoadmin 2024-06-08 人已围观
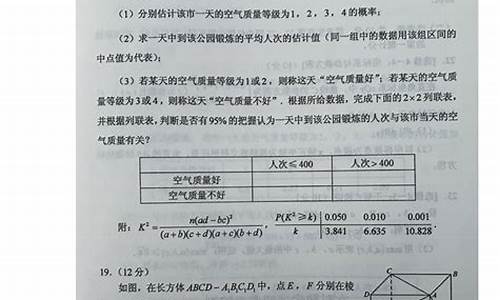
简介1.高三化学关于原电池和电解池2.高中化学电解和原电池问题!求高人3.高考化学的原电池电解池题怎么做4.#高考提分#求解电解池、原电池正负极的电极反应式分别怎么书写?总式呢?5.高三化学原电池电解池溶液是NaOH,两极分别是H2和Cl2堿性条件下,H2+2OH--2e-=2H2O,Cl2+2e-=2Cl-的电势差很大,大於了你Cu-2e-+2OH-=Cu(OH)2,O2+4e-+2H2O=4OH-
1.高三化学关于原电池和电解池
2.高中化学电解和原电池问题!求高人
3.高考化学的原电池电解池题怎么做
4.#高考提分#求解电解池、原电池正负极的电极反应式分别怎么书写?总式呢?
5.高三化学原电池电解池
溶液是NaOH,两极分别是H2和Cl2
堿性条件下,H2+2OH--2e-=2H2O,Cl2+2e-=2Cl-的电势差很大,大於了你Cu-2e-+2OH-=Cu(OH)2,O2+4e-+2H2O=4OH-的电势差,所以要优先反应.
电势差是通过数据计算出来的,而且就算没数据,你要想看氧气溶解度很小,吸氧腐蚀速率慢到没朋友,怎麼可能会马上使得电流表偏转?
高三化学关于原电池和电解池
化学电解池和原电池是电化学中的重要概念它们涉及到能量转换和物质转化。相关内容如下:
1、原电池:是一种将化学能转化为电能的装置,它由两个或多个半电池组成,半电池之间通过电解质溶液相连。在原电池中,氧化还原反应分别在两个半电池中进行,其中还原剂所在半电池为正极,氧化剂所在半电池为负极。
2、电解池:电解池是一种将电能转化为化学能的装置。在电解池中,通过外加电场的作用,电解质溶液中的离子在电极上发生氧化还原反应,从而实现物质的转化。电解池的两个电极分别为阳极和阴极,阳极发生氧化反应,阴极发生还原反应。
3、电解规律:在电解池中,阳离子得电子能力越强,氧化性越弱、阴离子得电子能力越强,还原性越弱。根据这一规律,可以判断出电解池中发生反应的顺序。
4、电解应用:电解在工业上有着广泛的应用,如电解法制备金属、电解精炼、电解冶炼、电镀等。此外,电解还在环境保护、能源开发等领域发挥着重要作用。
5、影响因素:影响电解的因素包括电流强度、电压、电解液浓度、温度等。在实际操作中,需要根据实际情况调整这些因素以达到最佳效果。
原电池的相关知识如下:
1、原电池是一种将化学能转化为电能的装置,它利用氧化还原反应将化学能转化为电能。原电池由两个或多个半电池组成,每个半电池包含一种化学物质,其中一个是还原剂阳极,另一个是氧化剂阴极。
2、原电池的种类很多,可以根据不同的标准进行分类。按照电极活性材料的不同,原电池可分为锌锰电池、碱性锌锰电池、锂离子电池等、按照工作原理的不同,原电池可分为一次电池、二次电池和燃料电池等。
3、原电池的工作原理是基于氧化还原反应的。在原电池中,还原剂在阳极上失去电子并被氧化,而氧化剂在阴极上获得电子并被还原。电子从阳极通过导线流向阴极,从而产生电流。这个过程可以看作是一个微观的化学反应过程,通过这个过程可以将化学能转化为电能。
4、原电池的应用非常广泛,它可以用于电力供应、电子产品、电动汽车等领域。此外,原电池还可以用于环保和能源开发等领域。例如,锂离子电池作为一种高性能的二次电池,被广泛应用于手机、笔记本电脑等领域。
5、原电池的发展历程经历了从早期的锌锰电池到现代的锂离子电池和燃料电池等不同阶段。随着科技的不断进步,原电池的性能和种类也在不断增加和完善。未来,随着人们对可再生能源和环保意识的不断提高,原电池的应用前景将会更加广阔。
高中化学电解和原电池问题!求高人
原电池:
原电池的原理是可以自发进行的氧化还原反应
一般是活泼性强的做负极,较差的做正极,有些你没有见过的反应,比如反应物 Ni,Ni(OH)2,产物NiOOH 这个电池反应,这是一个可充电的电池,分析化合价,镍0价,氢氧化镍中的镍+4价,氢氧化氧镍中的镍是+3价,所以就是镍失电子,做负极,氢氧化镍的电子,做正极。
电解池:
最重要的一点是记住做阴极的电极不会发生反应,即使他比阳极的电极活泼
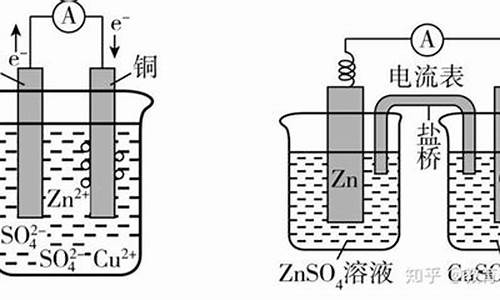
阳极是连接原电池的正极,发生氧化反应,首先先看电极的活泼性,Ag以前的金属做阳极,阳极金属失电子,包括银,以CU为例,CU做阳极,水做电解液,电解的实质是CU放电生成CU离子,水中的氢离子放电生成氢气,剩余的氢氧根跟CU离子结合成氢氧化铜
Cu+2H20=(通电)Cu(OH)2+H2(气体符号)
但是Mg做电极的话除外
比如AL MG NAOH这个原电池,虽然AL不如MG活泼,但MG本身不与氢氧化钠反应,所以是AL放电就是AL和NaOH反应的方程式
有不明白的再问我 (咱们都是高三的)
高考化学的原电池电解池题怎么做
甲池中电极反应式为:
阳极:2H2O-4e-==O2+4H+
阴极:2Cu2+ +4e-==2Cu
转移电子和生成气体的对应关系为4e-~O2,当电路中通过1mol电子时,产生的氧气为0.25mol。
乙池中电极反应式为:
负极:Mg-2e-==Mg2+
正极:2H+ +2e-==H2
转移电子和生气气体的对应关系为2e-~H2,当电路中通过1mol电子时,产生的氢气为0.5mol。
所以产生的气体体积不相等。
#高考提分#求解电解池、原电池正负极的电极反应式分别怎么书写?总式呢?
两个原则。
原电池是供电装置:两个不同的电极共处在一个电解液中,活泼的金属作负极,失电子被氧化。
电解池是用电装置:接电源负极的是阴极,发生还原反应。接电源正极的是阳极发生氧化反应。
高三化学原电池电解池
总式就是反应化学式
正负极的电极反应式就是半反应,正极(阴极)得到电子,负极(阳极)失去电子
也就是说正极对应的物质,氧化态上升
负极对应的物质,氧化态下降,
找到反应前后氧化态变化的物质,单独取出来做反应物和产物
然后看有没有缺漏哪些元素,补上可能的反应物
(如H不够,酸性下补H+,碱性下补H2O或OH-等)
最后根据电荷守恒配平,半反应式会包含电子得失,电子用e-表示
例子:铜锌原电池((-)Zn|ZnSO4||Cu|CuSO4(+))
总反应式:Zn+CuSO4==ZnSO4+Cu
因为反应前后,锌氧化态上升,铜氧化态下降,所以判定锌做负极,铜做正极
正极半反应:Zn==Zn2+ +2e-
负极半反应:Cu2+ +2e- == Cu
例子2:氢氧燃料电池((-)Pt|H2|H2O||O2|H2O|Pt(+))
总反应式:2H2+O2==2H2O
用同样的办法,氢气所在电极为负极,氧气为正极
如果反应环境是酸性,半反应式为:
正极:H2==2H+ +2e-
负极:O2+4H+ + 4e-==2H2O
反应环境是碱性,则为:
正极:H2+2OH-==2H2O +2e-
负极:O2+2H2O+4e-==4OH-
之所以举第二个例子是为了阐明反应环境对半反应式反应物和产物的影响
如有不明之处欢迎追问
1. 有带电源的就是电解池,没有电源的就是原电池。当然那要符合条件才能这么判断。图甲属于燃料电池(原电池)
2. 总反应式中有KOH但实际的氧化还原反应还是甲醇和氧气,所以你用2CH3OH+3O2=2CO2+4H2O减去3O2+6H2O+12e-=12OH-就可以得到CH3OH+6OH--6e-=CO2+5H2O.判断可以这样想:总反应(甲醇和氧气)反应前后的PH是不变的,也就是得保持中性,但是正极水和氧气得到电子,生成OH-,PH增大,为了保持PH=7,那么OH-就必须到负极消耗掉了。至于KOH,它只是电解质,如果是酸那好理解点,它不会反应,但碰巧它是碱,会和生成的CO2反应的碱,但实质“氧化还原反应”中它是没有参加的
3. 你的疑问是为什么阴极不会把H+变成H2跑掉吧。那是因为如果H+如果都变成H2跑掉,OH-也会结合Mg2+生成沉淀,那么溶液中就会剩下氯离子,变成带负电荷的溶液,但溶液总是要保持电中性,所以只有水得到电子生成的OH-结合Mg2+生成沉淀,溶液的电性才能保持中性。
上一篇:仝卓高考身份,高考身份