您现在的位置是: 首页 > 教育研究 教育研究
2013天津高考化学卷_2013年天津高考化学试卷
tamoadmin 2024-06-23 人已围观
简介1.天津高考时间2023年具体时间2.天津高考满分多少3.天津高考政策4.高考各个省都考什么卷子5.2023高考有几套卷子6.求对高考化学无机推断题有帮助的(天津地区常考的)成考快速报名和免费咨询: 天津成人高考一般来说都有哪几种考试题型?天津成人高考考试题型有几个报考层次区分。不同层次天津成人高考考试题型不尽相同。为了让考生迅速了解相关信息,天津成人高考网整理出以下天津成人高考考试题型相关内容,
1.天津高考时间2023年具体时间
2.天津高考满分多少
3.天津高考政策
4.高考各个省都考什么卷子
5.2023高考有几套卷子
6.求对高考化学无机推断题有帮助的(天津地区常考的)

成考快速报名和免费咨询: 天津成人高考一般来说都有哪几种考试题型?天津成人高考考试题型有几个报考层次区分。不同层次天津成人高考考试题型不尽相同。为了让考生迅速了解相关信息,天津成人高考网整理出以下天津成人高考考试题型相关内容,仅供参考,希望对大家有所帮助!
天津成人高考考试题型包括高起专、高起本和专升本考试科目题型。高起专、高起本考试科目题型又分为:选择题、非选择题、阅读题、阅读题、作文;数学:选择题、填空题、解答题等。
一、天津成人高考高起专、高起本考试科目题型分布:
①语文(高起专、高起本)
选择题、非选择题、阅读题、阅读题、作文
②英语(高起专、高起本)
题型:分为Ⅰ卷(选择题)和Ⅱ卷(非选择题)
③数学(文史)和数学(理工)(高起专、高起本)
试卷题型:分为Ⅰ卷(选择题)和Ⅱ卷(非选择题)
选择题、填空题、解答题
④历史地理(高起本)
试卷题型:选择题、非选择题
⑤物理化学(高起本)
试卷题型:选择题;非选择题:填空题、计算题
二、天津成人高考专升本考试科目题型分布:
①政治(专升本)
试卷内容比例:
马克思主义哲学原理,约28%;
毛泽东思想和中国特色社会主义理论体系概论,约65%;
时事,约7%。
试卷题型及分值:
单选题、辨析题、简答题、论述题
②英语(专升本)
试卷内容及题型分值:分为Ⅰ卷(选择题共125分)和Ⅱ卷(非选择题25分)
③高等数学(一)和高等数学(二)(专升本)
试卷题型及分值
选择题、填空题、解答题
④医学综合(专升本)
A型题、B型题、X型题
⑤大学语文(专升本)
试卷内容及题型:分为Ⅰ卷(选择题共40分)和Ⅱ卷(非选择题110分)
选择题、文言文阅读、现代文阅读
四、天津成人高考作文
⑥教育理论(专升本)
试卷内容及题型:分为教育学部分和心理学部分
教育学部分:
选择题、辨析题、简答题、论述题
心理学部分:
选择题、辨析题、简答题、论述题
⑦艺术概论(专升本)
试卷题型:分为Ⅰ卷(选择题共40分)和Ⅱ卷(非选择题110分)
选择题、简答题、作品分析题
四、天津成人高考论述题
⑧生态学基础(专升本)
选择题、填空题、判断题、简答题、论述题
⑨民法(专升本)
试卷题型:选择题、简答题 、论述题 、案例分析题
成考有疑问、不知道如何总结成考考点内容、不清楚成考报名当地政策,点击底部咨询官网,免费领取复习资料: style="font-size: 18px;font-weight: bold;border-left: 4px solid #a10d00;margin: 10px 0px 15px 0px;padding: 10px 0 10px 20px;background: #f1dada;">天津高考时间2023年具体时间
数学要想考一个好分数 概率题一定要拿满分
我感觉做概率题时首先要把题慢慢的读完 争取把题中的信息给收集起来 要知道题中的意思 这样一定能把概率题做出来
我化学就是选有机的 想学好有机 的话 有机中的各物质反应类型一定要熟 并且要特别注意反应条件 以及不是“==” 在做有机题之前要看清后面的提示,往往那些提示可以作为突破口,并且做有机时要善于“中间推”“倒推”
希望对你有帮助
个人观点,绝非粘帖!
天津高考满分多少
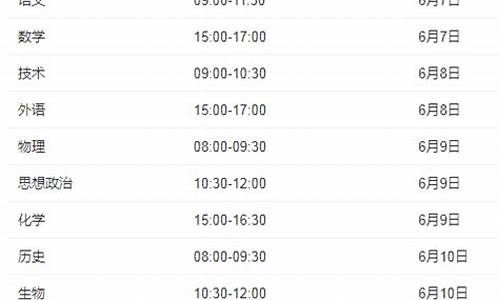
天津2023高考在是6月7日至10日举行。
2023年天津高考将于6月7日至10日举行,这是全国各省份的高考日期都相对较为集中的时期。高考是每个学生学业生涯中的一个重要节点,也是各级教育部门和社会各界关注的焦点。对于参加2023年天津高考的考生来说,这段时间是他们长期努力和准备的总结之时。
对于教育部门和社会各界来说,高考也是一项关注度极高的重要工作。要加强组织协作,落实各项考试安排,做好考生信息收集和管理工作,做到安全、公正、公平,确保高考工作的顺利进行。
天津2023年高考将在6月7日至10日举行,对于应届高考考生来说是他们人生中重要的一步,需要小心谨慎地为之做好准备。同时,教育部门和社会各界也应该以高度关注和重视态度,确保高考工作的顺利进行。
天津高考简介
天津高考简介是指在天津市举行的高等教育招生考试,也是全国高考的一个组成部分。天津高考是由天津市教育考试院主管,每年6月进行,考试科目包括语文、数学、外语、物理、化学、生物、政治和历史等八门学科,是衡量考生智力、知识、思维、应用等方面能力水平的最重要的考核方式之一。
天津高考成绩是中国高等教育招生考试的重要组成部分,考生的分数将影响其未来进入大学的选择和机会。本科大学、高职高专、技校以及成人高考等各类高等教育招生考试都会参考天津高考的成绩进行招生入学。
从整个天津市的角度来看,高考更是牵动着社会各界的关注,教育部门和各级政府都将高考作为教育改革、发展人才等方面的重大工作,维护高考的公正性、公平性、准确性和严肃性,提高全社会对教育事业的重视度,促进人才培养和社会进步。
天津高考政策
天津高考总分依然是750分,考试科目设置仍为“3+文科综合/理科综合”。 “3”是指语文、数学、外语。数学科目分为文史类与理工类,外语科目考试包括听力测试,文科综合科目包括政治、历史、地理,理科综合科目包括物理、化学、生物。高考各科目考试成绩均以原始分数的方式呈现。全部科目试卷的总分值为750分,其中语文、数学、外语科目的分值分别为150分,文科综合、理科综合科目的分值分别为300分;文科综合中政治、历史、地理科目试题的分值各为100分,理科综合中物理、化学、生物科目试题的分值分别为120分、100分、80分。
语文、数学、英语、文科综合、理科综合科目实行计算机网上评卷,提醒考生须在答题卡规定的区域内答题,在试卷上或草稿纸上答题无效。
高考各个省都考什么卷子
天津高考政策如下:
3+3模式。天津新高考改革详细要点解读:取消文理分科,考试科目实行“3+3”。2017年秋季入学的高一年级开始实施。英语一年两考,取较高的分数计入高考总分。
天津新高考改革方案内容
普通高中学业水平考试的科目类别与内容。普通高中学业水平考试分为合格性考试与等级性考试。合格性考试内容以国家发布的普通高中课程标准中必修课程的规定及要求为依据。
设置语文、数学、外语、思想政治、历史、地理、物理、化学、生物、信息技术、通用技术、音乐、体育与健康、美术14门科目,引导学生全面发展,避免过度偏科。等级性考试内容以国家发布的普通高中课程标准中的必修和选修课程的规定及要求为依据。
学生在完成必修内容的学习,对自己的兴趣和优势有一定了解后,根据报考高校要求和自身特长,在思想政治、历史、地理、物理、化学、生物6门科目中自主选择3门作为等级性考试科目。
普通高中学业水平考试组织方式
语文、数学、外语3门科目的合格性考试,思想政治、历史、地理、物理、化学、生物6门科目的合格性考试与等级性考试,由全市统一命题、统一组织考试、统一评卷。
信息技术、通用技术、音乐、体育与健康、美术5门科目的合格性考试,物理、化学、生物3门科目单设的实验操作合格性考查,由全市制定统一要求,分区县统一组织,各中学具体实施。
2023高考有几套卷子
高考各个省都考什么卷子如下:
一、全国甲卷:3+文科综合/理科综合使用地区:四川、广西、贵州(3省区)试卷科目:语文、数学、外语、文综、理综。
二、全国乙卷:3+文科综合/理科综合使用地区:内蒙古、陕西、甘肃、青海、宁夏、新疆、江西、河南(8省区)试卷科目:语文、数学、外语、文综、理综。
三、新课标全国Ⅰ卷:3+1+2/3+3使用地区:山东、广东、湖南、湖北、河北、江苏、福建、浙江(8省)试卷科目:语文、数学、外语、物理、化学、生物、政治、历史、地理、信息技术等。
四、新课标全国Ⅱ卷:3+1+2/3+3使用地区:辽宁、重庆、海南、云南、西藏、山西、安徽、吉林、黑龙江(9省市)试卷科目:语文、数学、外语、物理、化学、生物、政治、历史、地理等。
五、自主命题:天津卷、上海卷、北京卷(3+3)使用地区:天津、上海、北京(3市)试卷科目:语文、数学、外语、物理、化学、生物、政治、历史、地理等。
高考的意义和重要性
高考的意义决定你的人生方向。高考不是成功的唯一出路,但是高考却是你人生中很重要的经历。不是所有人都能对高考充满着期望,只要你进入高考就该珍惜这次人生磨砺。
人生一辈子都在成长,可每次的成长和经历都会留下不同烙印。高考是我们人生中最开始起步的烙印。它告诉我们未来的所有决策都从这里改变。高考之后你的人生才刚开始,无论学习和交流,是知识改变你的初衷。你对未来就会有更高的起点,你的社交也会变得与众不同,你的未来和方向不再让你迷茫。
高考之后,所有人都会为你而高兴,父母多年的付出和努力让他们看到了希望。他们再苦再累也都值得,你不是代表你自己,因为你的未来是整个家人对你的期望。国家更需要你们这些优秀的人才,只有你们才能让祖国更加强大。
求对高考化学无机推断题有帮助的(天津地区常考的)
2023高考有几套卷子介绍如下:
2023年全国高考一共有7套试卷,2023年除了浙江省高考试卷有所调整外,其余各省市采用的试卷基本与2022保持一致,浙江省语数外三科由原来的自主命题变为采用新高考一卷。
2023各省高考都用什么卷
一、全国甲卷(5省区):云南、四川、广西、贵州、西藏
二、全国乙卷(12省区):内蒙古、吉林、黑龙江、陕西、甘肃、青海、宁夏、新疆、山西、安徽、江西、河南
三、新高考全国一卷(8省):山东、广东、湖南、湖北、河北、江苏、福建、浙江
四、新高考全国二卷(3省市):辽宁、重庆、海南
五、天津卷:天津市
六、上海卷:上海市
七、北京卷:北京市
注:2023年实行新高考的14省市的物理、化学、生物、政治、历史、地理6科由本省市单独命卷。其中,浙江还另有技术科(含通用技术和信息技术)。具体以各省市发布官方信息为准。
2023各省高考考试时间
2023全国高考时间统一是每年的6月7日和8日,但实行高考改革之后,文综和理综考试需要分开考,因此部分省份考试时间会持续到6月9日或者是6月10日。
一、传统高考地区(除新高考地区以外的省份)高考时间为6月7日至8日,为期两天;(新疆、西藏、内蒙古9日考民族语文)
二、新高考3+1+2地区(河北、辽宁、江苏、福建、湖北、湖南、广东、重庆)高考时间为6月7日至9日,为期三天;
三、新高考3+3地区高考时间为6月7日至10日,为期四天。
常见方程式
非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si)
1, 氧化性:
F2 + H2 === 2HF
F2 +Xe(过量)===XeF2
2F2(过量)+Xe===XeF4
nF2 +2M===2MFn (表示大部分金属)
2F2 +2H2O===4HF+O2
2F2 +2NaOH===2NaF+OF2 +H2O
F2 +2NaCl===2NaF+Cl2
F2 +2NaBr===2NaF+Br2
F2+2NaI ===2NaF+I2
F2 +Cl2 (等体积)===2ClF
3F2 (过量)+Cl2===2ClF3
7F2(过量)+I2 ===2IF7
Cl2 +H2 ===2HCl
3Cl2 +2P===2PCl3
Cl2 +PCl3 ===PCl5
Cl2 +2Na===2NaCl
3Cl2 +2Fe===2FeCl3
Cl2 +2FeCl2 ===2FeCl3
Cl2+Cu===CuCl2
2Cl2+2NaBr===2NaCl+Br2
Cl2 +2NaI ===2NaCl+I2
5Cl2+I2+6H2O===2HIO3+10HCl
Cl2 +Na2S===2NaCl+S
Cl2 +H2S===2HCl+S
Cl2+SO2 +2H2O===H2SO4 +2HCl
Cl2 +H2O2 ===2HCl+O2
2O2 +3Fe===Fe3O4
O2+K===KO2
S+H2===H2S
2S+C===CS2
S+Fe===FeS
S+2Cu===Cu2S
3S+2Al===Al2S3
S+Zn===ZnS
N2+3H2===2NH3
N2+3Mg===Mg3N2
N2+3Ca===Ca3N2
N2+3Ba===Ba3N2
N2+6Na===2Na3N
N2+6K===2K3N
N2+6Rb===2Rb3N
P2+6H2===4PH3
P+3Na===Na3P
2P+3Zn===Zn3P2
2.还原性
S+O2===SO2
S+O2===SO2
S+6HNO3(浓)===H2SO4+6NO2+2H2O
3S+4 HNO3(稀)===3SO2+4NO+2H2O
N2+O2===2NO
4P+5O2===P4O10(常写成P2O5)
2P+3X2===2PX3 (X表示F2,Cl2,Br2)
PX3+X2===PX5
P4+20HNO3(浓)===4H3PO4+20NO2+4H2O
C+2F2===CF4
C+2Cl2===CCl4
2C+O2(少量)===2CO
C+O2(足量)===CO2
C+CO2===2CO
C+H2O===CO+H2(生成水煤气)
2C+SiO2===Si+2CO(制得粗硅)
Si(粗)+2Cl===SiCl4
(SiCl4+2H2===Si(纯)+4HCl)
Si(粉)+O2===SiO2
Si+C===SiC(金刚砂)
Si+2NaOH+H2O===Na2SiO3+2H2
,(碱中)歧化
Cl2+H2O===HCl+HClO
(加酸抑制歧化,加碱或光照促进歧化)
Cl2+2NaOH===NaCl+NaClO+H2O
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
3Cl2+6KOH(热,浓)===5KCl+KClO3+3H2O
3S+6NaOH===2Na2S+Na2SO3+3H2O
4P+3KOH(浓)+3H2O===PH3+3KH2PO2
11P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO4
3C+CaO===CaC2+CO
3C+SiO2===SiC+2CO
二,金属单质(Na,Mg,Al,Fe)的还原性
2Na+H2===2NaH
4Na+O2===2Na2O
2Na2O+O2===2Na2O2
2Na+O2===Na2O2
2Na+S===Na2S(爆炸)
2Na+2H2O===2NaOH+H2
2Na+2NH3===2NaNH2+H2
4Na+TiCl4(熔融)===4NaCl+Ti
Mg+Cl2===MgCl2
Mg+Br2===MgBr2
2Mg+O2===2MgO
Mg+S===MgS
Mg+2H2O===Mg(OH)2+H2
2Mg+TiCl4(熔融)===Ti+2MgCl2
Mg+2RbCl===MgCl2+2Rb
2Mg+CO2===2MgO+C
2Mg+SiO2===2MgO+Si
Mg+H2S===MgS+H2
Mg+H2SO4===MgSO4+H2
2Al+3Cl2===2AlCl3
4Al+3O2===2Al2O3(钝化)
4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg
4Al+3MnO2===2Al2O3+3Mn
2Al+Cr2O3===Al2O3+2Cr
2Al+Fe2O3===Al2O3+2Fe
2Al+3FeO===Al2O3+3Fe
2Al+6HCl===2AlCl3+3H2
2Al+3H2SO4===Al2(SO4)3+3H2
2Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O
(Al,Fe在冷,浓的H2SO4,HNO3中钝化)
Al+4HNO(稀)===Al(NO3)3+NO+2H2O
2Al+2NaOH+2H2O===2NaAlO2+3H2
2Fe+3Br2===2FeBr3
Fe+I2===FeI2
Fe+S===FeS
3Fe+4H2O(g)===Fe3O4+4H2
Fe+2HCl===FeCl2+H2
Fe+CuCl2===FeCl2+Cu
Fe+SnCl4===FeCl2+SnCl2
(铁在酸性环境下,不能把四氯化锡完全
还原为单质锡 Fe+SnCl2==FeCl2+Sn)
三, 非金属氢化物(HF,HCl,H2O,H2S,NH3)
1,还原性:
4HCl(浓)+MnO2===MnCl2+Cl2+2H2O
4HCl(g)+O2===2Cl2+2H2O
16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O
14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2+7H2O
2H2O+2F2===4HF+O2
2H2S+3O2(足量)===2SO2+2H2O
2H2S+O2(少量)===2S+2H2O
2H2S+SO2===3S+2H2O
H2S+H2SO4(浓)===S+SO2+2H2O
3H2S+2HNO(稀)===3S+2NO+4H2O
5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S+8H2O
3H2S+K2Cr2O7+4H2SO4===Cr2(SO4)3+K2SO4+3S+7H2O
H2S+4Na2O2+2H2O===Na2SO4+6NaOH
2NH3+3CuO===3Cu+N2+3H2O
2NH3+3Cl2===N2+6HCl
8NH3+3Cl2===N2+6NH4Cl
4NH3+3O2(纯氧)===2N2+6H2O
4NH3+5O2===4NO+6H2O
4NH3+6NO===5N2+6HO(用氨清除NO)
NaH+H2O===NaOH+H2
4NaH+TiCl4===Ti+4NaCl+2H2
CaH2+2H2O===Ca(OH)2+2H2
2,酸性:
4HF+SiO2===SiF4+2H2O
(此反应广泛应用于测定矿样或钢样中SiO2的含量)
2HF+CaCl2===CaF2+2HCl
H2S+Fe===FeS+H2
H2S+CuCl2===CuS+2HCl
H2S+2AgNO3===Ag2S+2HNO3
H2S+HgCl2===HgS+2HCl
H2S+Pb(NO3)2===PbS+2HNO3
H2S+FeCl2===
2NH3+2Na==2NaNH2+H2
(NaNH2+H2O===NaOH+NH3)
3,碱性:
NH3+HCl===NH4Cl
NH3+HNO3===NH4NO3
2NH3+H2SO4===(NH4)2SO4
NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl
(此反应用于工业制备小苏打,苏打)
4,不稳定性:
2HF===H2+F2
2HCl===H2+Cl2
2H2O===2H2+O2
2H2O2===2H2O+O2
H2S===H2+S
2NH3===N2+3H2
四,非金属氧化物
低价态的还原性:
2SO2+O2===2SO3
2SO2+O2+2H2O===2H2SO4
(这是SO2在大气中缓慢发生的环境化学反应)
SO2+Cl2+2H2O===H2SO4+2HCl
SO2+Br2+2H2O===H2SO4+2HBr
SO2+I2+2H2O===H2SO4+2HI
SO2+NO2===SO3+NO
2NO+O2===2NO2
NO+NO2+2NaOH===2NaNO2
(用于制硝酸工业中吸收尾气中的NO和NO2)
2CO+O2===2CO2
CO+CuO===Cu+CO2
3CO+Fe2O3===2Fe+3CO2
CO+H2O===CO2+H2
氧化性:
SO2+2H2S===3S+2H2O
SO3+2KI===K2SO3+I2
NO2+2KI+H2O===NO+I2+2KOH
(不能用淀粉KI溶液鉴别溴蒸气和NO2)
4NO2+H2S===4NO+SO3+H2O
2NO2+Cu===4CuO+N2
CO2+2Mg===2MgO+C
(CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)
SiO2+2H2===Si+2H2O
SiO2+2Mg===2MgO+Si
3,与水的作用:
SO2+H2O===H2SO3
SO3+H2O===H2SO4
3NO2+H2O===2HNO3+NO
N2O5+H2O===2HNO3
P2O5+H2O===2HPO3
P2O5+3H2O===2H3PO4
(P2O5极易吸水,可作气体干燥剂
P2O5+3H2SO4(浓)===2H3PO4+3SO3)
CO2+H2O===H2CO3
4,与碱性物质的作用:
SO2+2NH3+H2O===(NH4)2SO3
SO2+(NH4)2SO3+H2O===2NH4HSO3
(这是硫酸厂回收SO2的反应.先用氨水吸收SO2,
再用H2SO4处理: 2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2
生成的硫酸铵作化肥,SO2循环作原料气)
SO2+Ca(OH)2===CaSO3+H2O
(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)
SO3+MgO===MgSO4
SO3+Ca(OH)2===CaSO4+H2O
CO2+2NaOH(过量)===Na2CO3+H2O
CO2(过量)+NaOH===NaHCO3
CO2+Ca(OH)2(过量)===CaCO3+H2O
2CO2(过量)+Ca(OH)2===Ca(HCO3)2
CO2+2NaAlO2+3H2O===2Al(OH)3+Na2CO3
CO2+C6H5ONa+H2O===C6H5OH+NaHCO3
SiO2+CaO===CaSiO3
SiO2+2NaOH===Na2SiO3+H2O
(常温下强碱缓慢腐蚀玻璃)
SiO2+Na2CO3===Na2SiO3+CO2
SiO2+CaCO3===CaSiO3+CO2
五,金属氧化物
1,低价态的还原性:
6FeO+O2===2Fe3O4
FeO+4HNO3===Fe(NO3)3+NO2+2H2O
2,氧化性:
Na2O2+2Na===2Na2O
(此反应用于制备Na2O)
MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al.
一般通过电解制Mg和Al.
Fe2O3+3H2===2Fe+3H2O (制还原铁粉)
Fe3O4+4H2===3Fe+4H2O
3,与水的作用:
Na2O+H2O===2NaOH
2Na2O2+2H2O===4NaOH+O2
(此反应分两步:Na2O2+2H2O===2NaOH+H2O2 ;
2H2O2===2H2O+O2. H2O2的制备可利用类似的反应:
BaO2+H2SO4(稀)===BaSO4+H2O2)
MgO+H2O===Mg(OH)2 (缓慢反应)
4,与酸性物质的作用:
Na2O+SO3===Na2SO4
Na2O+CO2===Na2CO3
Na2O+2HCl===2NaCl+H2O
2Na2O2+2CO2===2Na2CO3+O2
Na2O2+H2SO4(冷,稀)===Na2SO4+H2O2
MgO+SO3===MgSO4
MgO+H2SO4===MgSO4+H2O
Al2O3+3H2SO4===Al2(SO4)3+3H2O
(Al2O3是两性氧化物:
Al2O3+2NaOH===2NaAlO2+H2O)
FeO+2HCl===FeCl2+3H2O
Fe2O3+6HCl===2FeCl3+3H2O
Fe2O3+3H2S(g)===Fe2S3+3H2O
Fe3O4+8HCl===FeCl2+2FeCl3+4H2O
六,含氧酸
1,氧化性:
4HClO3+3H2S===3H2SO4+4HCl
HClO3+HI===HIO3+HCl
3HClO+HI===HIO3+3HCl
HClO+H2SO3===H2SO4+HCl
HClO+H2O2===HCl+H2O+O2
(氧化性:HClO>HClO2>HClO3>HClO4,
但浓,热的HClO4氧化性很强)
2H2SO4(浓)+C===CO2+2SO2+2H2O
2H2SO4(浓)+S===3SO2+2H2O
H2SO4+Fe(Al) 室温下钝化
6H2SO4(浓)+2Fe===Fe2(SO4)3+3SO2+6H2O
2H2SO4(浓)+Cu===CuSO4+SO2+2H2O
H2SO4(浓)+2HBr===SO2+Br2+2H2O
H2SO4(浓)+2HI===SO2+I2+2H2O
H2SO4(稀)+Fe===FeSO4+H2
2H2SO3+2H2S===3S+2H2O
4HNO3(浓)+C===CO2+4NO2+2H2O
6HNO3(浓)+S===H2SO4+6NO2+2H2O
5HNO3(浓)+P===H3PO4+5NO2+H2O
6HNO3+Fe===Fe(NO3)3+3NO2+3H2O
4HNO3+Fe===Fe(NO3)3+NO+2H2O
30HNO3+8Fe===8Fe(NO3)3+3N2O+15H2O
36HNO3+10Fe===10Fe(NO3)3+3N2+18H2O
30HNO3+8Fe===8Fe(NO3)3+3NH4NO3+9H2O
2,还原性:
H2SO3+X2+H2O===H2SO4+2HX
(X表示Cl2,Br2,I2)
2H2SO3+O2===2H2SO4
H2SO3+H2O2===H2SO4+H2O
5H2SO3+2KMnO4===2MnSO4+K2SO4+2H2SO4+3H2O
H2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl
3,酸性:
H2SO4(浓) +CaF2===CaSO4+2HF
H2SO4(浓)+NaCl===NaHSO4+HCl
H2SO4(浓) +2NaCl===Na2SO4+2HCl
H2SO4(浓)+NaNO3===NaHSO4+HNO3
3H2SO4(浓)+Ca3(PO4)2===3CaSO4+2H3PO4
2H2SO4(浓)+Ca3(PO4)2===2CaSO4+Ca(H2PO4)2
3HNO3+Ag3PO4===H3PO4+3AgNO3
2HNO3+CaCO3===Ca(NO3)2+H2O+CO2
(用HNO3和浓H2SO4不能制备H2S,HI,HBr,(SO2)
等还原性气体)
4H3PO4+Ca3(PO4)2===3Ca(H2PO4)2(重钙)
H3PO4(浓)+NaBr===NaH2PO4+HBr
H3PO4(浓)+NaI===NaH2PO4+HI
4,不稳定性:
2HClO===2HCl+O2
4HNO3===4NO2+O2+2H2O
H2SO3===H2O+SO2
H2CO3===H2O+CO2
H4SiO4===H2SiO3+H2O
七,碱
低价态的还原性:
4Fe(OH)2+O2+2H2O===4Fe(OH)3
与酸性物质的作用:
2NaOH+SO2(少量)===Na2SO3+H2O
NaOH+SO2(足量)===NaHSO3
2NaOH+SiO2===NaSiO3+H2O
2NaOH+Al2O3===2NaAlO2+H2O
2NaOH+Cl2===NaCl+NaClO+H2O
NaOH+HCl===NaCl+H2O
NaOH+H2S(足量)===NaHS+H2O
2NaOH+H2S(少量)===Na2S+2H2O
3NaOH+AlCl3===Al(OH)3+3NaCl
NaOH+Al(OH)3===NaAlO2+2H2O
(AlCl3和Al(OH)3哪个酸性强?)
NaOH+NH4Cl===NaCl+NH3+H2O
Mg(OH)2+2NH4Cl===MgCl2+2NH3.H2O
Al(OH)3+NH4Cl 不溶解
3,不稳定性:
Mg(OH)2===MgO+H2O
2Al(OH)3===Al2O3+3H2O
2Fe(OH)3===Fe2O3+3H2O
Cu(OH)2===CuO+H2O
八,盐
1,氧化性:
2FeCl3+Fe===3FeCl2
2FeCl3+Cu===2FeCl2+CuCl2
(用于雕刻铜线路版)
2FeCl3+Zn===2FeCl2+ZnCl2
FeCl3+Ag===FeCl2+AgC
Fe2(SO4)3+2Ag===FeSO4+Ag2SO4(较难反应)
Fe(NO3)3+Ag 不反应
2FeCl3+H2S===2FeCl2+2HCl+S
2FeCl3+2KI===2FeCl2+2KCl+I2
FeCl2+Mg===Fe+MgCl2
2,还原性:
2FeCl2+Cl2===2FeCl3
3Na2S+8HNO3(稀)===6NaNO3+2NO+3S+4H2O
3Na2SO3+2HNO3(稀)===3Na2SO4+2NO+H2O
2Na2SO3+O2===2Na2SO4
3,与碱性物质的作用:
MgCl2+2NH3.H2O===Mg(OH)2+NH4Cl
AlCl3+3NH3.H2O===Al(OH)3+3NH4Cl
FeCl3+3NH3.H2O===Fe(OH)3+3NH4Cl
4,与酸性物质的作用:
Na3PO4+HCl===Na2HPO4+NaCl
Na2HPO4+HCl===NaH2PO4+NaCl
NaH2PO4+HCl===H3PO4+NaCl
Na2CO3+HCl===NaHCO3+NaCl
NaHCO3+HCl===NaCl+H2O+CO2
3Na2CO3+2AlCl3+3H2O===2Al(OH)3+3CO2+6NaCl
3Na2CO3+2FeCl3+3H2O===2Fe(OH)3+3CO2+6NaCl
3NaHCO3+AlCl3===Al(OH)3+3CO2
3NaHCO3+FeCl3===Fe(OH)3+3CO2
3Na2S+Al2(SO4)3+6H2O===2Al(OH)3+3H2S
3NaAlO2+AlCl3+6H2O===4Al(OH)3
5,不稳定性:
Na2S2O3+H2SO4===Na2SO4+S+SO2+H2O
NH4Cl===NH3+HCl
NH4HCO3===NH3+H2O+CO2
2KNO3===2KNO2+O2
2Cu(NO3)3===2CuO+4NO2+O2
2KMnO4===K2MnO4+MnO2+O2
2KClO3===2KCl+3O2
2NaHCO3===Na2CO3+H2O+CO2
Ca(HCO3)2===CaCO3+H2O+CO2
CaCO3===CaO+CO2
MgCO3===MgO+CO2
几种重要阳离子的检验
(l)H+ 能使紫色石蕊试液或橙色的甲基橙试液变为红色。
(2)Na+、K+ 用焰色反应来检验时,它们的火焰分别呈**、浅紫色(通过钴玻片)。
(3)Ba2+ 能使稀硫酸或可溶性硫酸盐溶液产生白色BaSO4沉淀,且沉淀不溶于稀硝酸。
(4)Mg2+ 能与NaOH溶液反应生成白色Mg(OH)2沉淀,该沉淀能溶于NH4Cl溶液。
(5)Al3+ 能与适量的NaOH溶液反应生成白色Al(OH)3絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液
(6)Ag+ 能与稀盐酸或可溶性盐酸盐反应,生成白色AgCl沉淀,不溶于稀 HNO3,但溶于氨水,生成〔
Ag(NH3)2〕+。
(7)NH4+ 铵盐(或浓溶液)与NaOH浓溶液反应,并加热,放出使湿润的红色石蓝试纸变蓝的有刺激性
气味NH3气体。
(8)Fe2+ 能与少量NaOH溶液反应,先生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe
(OH)3沉淀。或向亚铁盐的溶液里加入KSCN溶液,不显红色,加入少量新制的氯水后,立即显红色。
2Fe2++Cl2=2Fe3++2Cl-
(9) Fe3+ 能与 KSCN溶液反应,变成血红色 Fe(SCN)3溶液,能与 NaOH溶液反应,生成红褐色Fe
(OH)3沉淀。
(10)Cu2+ 蓝色水溶液(浓的CuCl2溶液显绿色),能与NaOH溶液反应,生成蓝色的Cu(OH)2沉淀,加
热后可转变为黑色的 CuO沉淀。含Cu2+溶液能与Fe、Zn片等反应,在金属片上有红色的铜生成。
几种重要的阴离子的检验
(1)OH- 能使无色酚酞、紫色石蕊、橙色的甲基橙等指示剂分别变为红色、蓝色、**。
(2)Cl- 能与硝酸银反应,生成白色的AgCl沉淀,沉淀不溶于稀硝酸,能溶于氨水,生成[Ag(NH3)
2]+。
(3)Br- 能与硝酸银反应,生成淡**AgBr沉淀,不溶于稀硝酸。
(4)I- 能与硝酸银反应,生成**AgI沉淀,不溶于稀硝酸;也能与氯水反应,生成I2,使淀粉溶
液变蓝。
(5)SO42- 能与含Ba2+溶液反应,生成白色BaSO4沉淀,不溶于硝酸。
(6)SO32- 浓溶液能与强酸反应,产生无色有刺激性气味的SO2气体,该气体能使品红溶液褪色。能与
BaCl2溶液反应,生成白色BaSO3沉淀,该沉淀溶于盐酸,生成无色有刺激性气味的SO2气体。
(7)S2- 能与Pb(NO3)2溶液反应,生成黑色的PbS沉淀。
(8)CO32- 能与BaCl2溶液反应,生成白色的BaCO3沉淀,该沉淀溶于硝酸(或盐酸),生成无色无味
、能使澄清石灰水变浑浊的CO2气体。
(9)HCO3- 取含HCO3-盐溶液煮沸,放出无色无味CO2气体,气体能使澄清石灰水变浑浊或向HCO3-盐
酸溶液里加入稀MgSO4溶液,无现象,加热煮沸,有白色沉淀 MgCO3生成,同时放出 CO2气体。
(10)PO43- 含磷酸根的中性溶液,能与AgNO3反应,生成**Ag3PO4沉淀,该沉淀溶于硝酸。
(11)NO3- 浓溶液或晶体中加入铜片、浓硫酸加热,放出红棕色气体。
这些方程式够用了吧,颜色的话,自己问老师就行
fe的变色反映试验
FeCl3溶液中滴加KSCN溶液显红色
FeCl3能使石蕊变红
FeCl3滴加氢氧化钠溶液生成红褐色沉淀
FeCl3通入H2S生成淡**沉淀
FeCl3加入过量铁粉溶液由棕**变为浅绿色
FeCl3加入过量铜粉溶液变蓝色
FeCl3加入到淀粉——KI溶液中变蓝
FeCl3加入苯酚变紫色
FeCl3加入硝酸银溶液,声称白色沉淀
FeCl3与NaHCO3溶液混合放出气体,并有红褐色沉淀生成
淡**: 硫 Na2O2 AgBr
** :FeS2 AgI Ag3PO4
颜色
石墨 黑色
金刚石 无色
硅 灰黑色
白磷 白或**
红磷 红棕色
硫 淡**
F2 淡黄绿色
Cl2 黄绿色
Br2 深红棕色
I2 紫黑色
铜 紫红色
金 金色
铯 金色
氧化物
NO2红棕色
N2O4无色
Na2O2淡**
FeO黑色
Fe2O3红棕色
Fe3O4黑色
MnO2黑色
CuO黑色
Cu2O红色
HgO红色
Ag2O棕黑色
酸或碱
碱(固体)白色
碱(晶体)无色
Fe(OH)2白色
Fe(OH)3红褐色
Cu(OH)2蓝色
盐
FeS黑色
FeS2**
CuS黑色
Cu2S黑色
HgS黑色
PbS黑色
FeCl3·6H2O 棕褐色
FeSO4·7H2O绿色
CuCl2棕**
CuSO4白色
Cu2(OH)2CO3绿色
CuSO4·5H2O 蓝色
AgCl白色
AgBr淡**
AgI**
Ag2CO3白色
Ag3PO4**
KMnO4紫黑色
水合离子或络离子
Cu2+蓝色
Fe2+浅绿色
Fe3+棕**
MnO4-紫红色
[CuCl4]2- **
Fe(SCN) 2+ 红色
补充CuSO4溶液为蓝色
CuCl2稀溶液溶液为蓝绿色 浓溶液为绿色
常见的焰色反应
含钠元素Na 黄
含锂元素Li 紫红
含钾元素K 浅紫焰色反应(透过蓝色钴玻璃观察,因为钾里面常混有钠,**掩盖了浅紫色)
含铷元素Rb 紫
含钙元素Ca 砖红色
含锶元素Sr 洋红
含铜元素Cu 绿
含钡元素Ba 黄绿
含钴元素Co 淡蓝
含铁元素Fe 无色