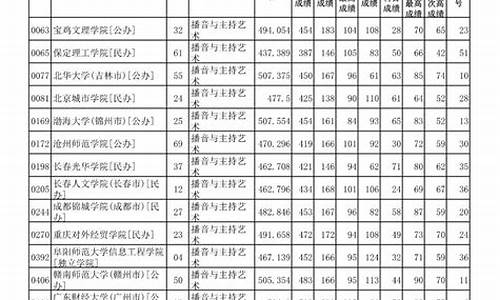
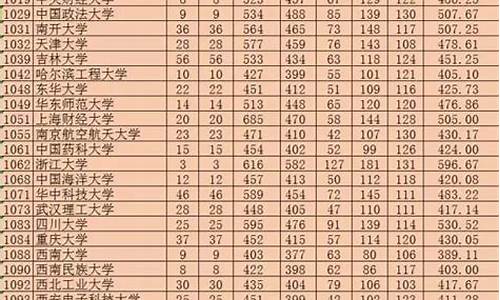
您现在的位置是: 首页 > 教育研究 教育研究
2017江苏高考理化答案,2017江苏高考理化答案解析
tamoadmin 2024-06-06 人已围观
简介1.2017年江苏高考作文精选合集三篇2.2022年新高考江苏卷各科试卷及参考答案解析汇总2018届江苏高考化学模拟试卷题目 第Ⅰ卷(选择题,共40分) 一、选择题(每题只有一个选项正确,每小题2分,共20分) 1.化学与生产、生活、科技、环境等密切相关,下列说法不正确的是 A.用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 B.用合成聚碳酸酯可降解塑料,实现?碳?的循
1.2017年江苏高考作文精选合集三篇
2.2022年新高考江苏卷各科试卷及参考答案解析汇总

2018届江苏高考化学模拟试卷题目
第Ⅰ卷(选择题,共40分)
一、选择题(每题只有一个选项正确,每小题2分,共20分)
1.化学与生产、生活、科技、环境等密切相关,下列说法不正确的是
A.用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气
B.用合成聚碳酸酯可降解塑料,实现?碳?的循环利用
C.大力实施矿物燃料脱硫脱硝技术,能减少二氧化硫、氮氧化物的排放
D.向工业生产的反应中加入合适的催化剂,能改变反应的焓变
2.下列有关化学用语表示正确的是
A. CO2分子的比例模型:
B.过氧化氢的电子式:
C.氟原子的结构示意图:
D.H2CO3的电离方程式:H2CO32H++CO32-
3.下列物质性质与应用关系不正确的是
A.SO2具有漂白性,能使滴有酚酞的NaOH溶液褪色
B. Na2O2与水和二氧化碳反应都会生成氧气,可用作供氧剂
C.MgO、Al2O3熔点高,可用于耐高温材料
D.常温下,铝与浓硝酸发生钝化,可用铝槽车贮运浓硝酸
4.常温下,下列各组离子在指定溶液中能大量共存的是
A.加入铝粉能产生氢气的溶液:Mg2+、K+、Br-、HCO3-
B.滴入石蕊显红色的溶液:Na+、K+、S2-、NO3-
C.pH=14的溶液中:Na+、AlO2-、SO42-、Cl-
D.滴入KSCN溶液显红色的溶液中:Ca2+、H+、I-、Cl-
5. NA为阿伏伽德罗常数的值,下列说法正确的是
A.16g由O2和O3的混合气体中含有的分子数为0.5NA
B.2.3g金属钠在装有氧气的集气瓶中完全燃烧,转移的电子数为0.1NA
C.100mL 12mol/L浓盐酸与足量MnO2共热,生成的Cl2分子数为0.3NA
D.0.3molAgNO3受热完全分解(2AgNO3 2Ag+2NO2?+O2? ),用排水收集到气体的分子数为0.25NA
6.下列实验装置不能达到目的的是
A.装置甲:用于吸收HCl气体
B.装置乙:用于除去NO2中的NO
C.装置丙:可验证氨气极易溶于水
D.装置丁:可形成喷泉
7.下列反应的离子方程式书写正确的是
A.1.0mol/L的NaAlO2溶液和2.5mol/L的盐酸等体积混合2AlO2-+5H+=Al3++Al(OH)3?+H2O
B.铜溶于0.5 mol.L-1的硝酸中:Cu+4H++2 NO3-═Cu2++2NO2?+2H2O
C.工业上将Cl2通人石灰乳中制漂白粉:Cl2+2OH-═Cl-+ClO-+H2O
D.向Ba(OH)2溶液中加入少量的NH4HSO4溶液:Ba2++OH-+H++ SO42-═BaSO4?+H2O
8.短周期主族元素X、Y、Z、W的原子序数依次递增,X的一种原子核内无中子,Y原子最外层电子数是内层电子总数的2倍,W原子最外层电子数是Y原子最外层电子数的1.5倍,Z、W同主族,下列说法正确的是
A.X与Y形成原子个数比1:1的.化合物只有2种
B.Y、W的氧化物均为酸性氧化物
C.最高价氧化物对应水化物的酸性:Y<w p=""> </w>
D.X与Z形成的化合物中,各原子均满足8电子稳定结构
9.X、Y、Z、W四种物质间的转化关系如图所示,下列转化关系中不能一步实现的是
选项 X Y Z W
A Na Na2O2 NaOH NaCl
B H2S SO2 SO3 H2SO4
C Fe FeCl3 Fe(OH)3 Fe2O3
D AlCl3 NaAlO2 Al(OH)3 Al
10.某电化学气敏传感器的工作原理如图所示,下列说法正确的是
A.b极为负极
B.a极的电极反应式为2NH3+3O2--6e-═N2+3H2O
C.反应消耗的NH3与O2的物质的量之比为4:5
D.该传感器在工作过程中KOH的物质的量不变
二、不定项选择题(每小题有1-2个选项符合题意,每小题4分,共20分,全对得4分,漏选得2分,错选或多选得0分)
11. N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,其反应为N2O(g)+CO(g) CO2(g)+N2(g) △H,有关化学反应的物质变化过程(图1)及能量变化过程(图2)如下:
下列说法正确的是
A.由图1可知:△H1=△H+△H2
B.由图2可知△H =-226 kJ/mol
C.为了实现转化需不断向反应器中补充Pt2O+和Pt2O2+
D.由图2可知该反应正反应的活化能大于逆反应的活化能
12. 奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )
A.奎宁酸的相对分子质量比莽草酸的大18
B.可用高锰酸钾溶液鉴别奎宁酸和莽草酸
C.等物质的量的奎宁酸和莽草酸分别与足量Na反应,同温同压下产生H2的体积比为4:5
D.等物质的量的两种分别与足量NaOH溶液反应,消耗NaOH的物质的量相同
13.下列实验对应的现象及结论均正确且两者具有因果关系的是
选项 实验 现象 结论
A 将SO2通入BaCl2溶液,然后滴入稀硝酸 白色沉淀,白色沉淀不溶于稀硝酸 所得沉淀为BaSO3,后转化为BaSO4
B 浓硫酸滴入蔗糖中,并搅拌 得黑色蓬松的固体并有刺激性气味气体 该过程中浓硫酸仅体现吸水性和脱水性
C 向FeCl2溶液中加入足量Na2O2粉末 出现红褐色沉淀和无色气体 FeCl2溶液部分变质
D 向足量含淀粉的FeI2溶液中滴加2滴氯水 溶液变蓝 还原性:I->Fe2+
14. 25℃时,将amol mol/L、pH=m的一元酸HX溶液与ba mol/L、pH=n的一元碱YOH溶液等体积混合,下列说法正确的是( )
A.混合溶液中一定有:c(X-)=c(Y+)=c(H+)-c(OH-)
B.若m+n=14,则混合后溶液一定显中性
C.若混合后溶液中c(X-)<c(y+),则该混合溶液一定显碱性 p=""> </c(y+),则该混合溶液一定显碱性>
D.若a=b,混合后溶液pH<7,则混合溶液中一定存在:c(Y-)=c(X-)+c(HX)
15. 已知反应2N2O5(g) 4NO2(g)+O2(g)的分解速率表达式为v正=k正.cm(N2O5),k正是与温度有关的常数,340K时实验测得的有关数据如下:
t/min 1 2 3 4
c(N2O5)/mol.L-1 0.133 0.080 0.057 0.040
v正/mol.L-1.min-1 0.0466 0.028 0.020 0.014
下列有关叙述不正确的是( )
A.340K时,速率表达式中m=1
B.340K时,速率表达式中k正?0.35min-1
C.340K时,若c(N2O3)=0.100mol.L-1,则v正?0.035mol.L-1.min
D.若t=2min时升高温度,则m不变,k正减小
第Ⅱ卷(非选择题,共80分)
16.钼酸钠晶体(Na2MoO4?2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如图所示:
(1)Na2MoO4?2H2O中钼元素的化合价为__________;
(2)焙烧时为了使钼精矿充分反应,可采取的措施是__________(答出一条即可);
(3)焙烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2 MoO3+SO2(未配平),该反应中氧化产物是__________(填化学式);当生成1molSO2时,该反应转移的电子的物质的量为__________mol;
(4)碱浸时,MoO3与Na2CO3溶液反应的离子方程式为__________;
(5)过滤后的碱浸液结晶前需加入Ba(OH)2固体以除去SO42-.当BaMoO4开始沉淀时,SO42-的去除率为97.5%,已知:碱浸液中c(MoO42-)=0.40mol?L-1,c(SO42-)=0.040mol?L-1,Ksp(BaSO4)=1.0?10-10、则Ksp(BaMoO4)=__________[加入Ba(OH)2固体引起的溶液体积变化可忽略]
17.(15分)Methylon(1,3-亚甲塞双氧甲基卡西酮)的一种合成路线如下:
(1)A的分子式为__________;B的结构简式为__________;
(2)D中含氧官能团的名称为__________;
(3)反应⑤的反应类型是__________;
(4)B的同分异构体中能同时满足下列条件的共有__________种(不含立体异构)
a.属于芳香族化合物 b.能与NaOH溶液反应 c.结构中除苯环外不含其他环状结构
其中核磁共振氢谱显示只有4组峰,且不能发生银镜反应的同分异构体是__________(填结构简式);
(5)参照上述Methylon的合成路线并结合,设计一种以苯和乙酸为原料制备香料2-羟基苯乙酮( )的合成路线。
18.(12分)水滑石材料在石油化学、塑料工业等方面均具有广泛用途,某活动小组同学进行如下实验制备某水滑石并测定其组成。
Ⅰ.水滑石的制备
(1)配制一定浓度的Mg(NO3)2与Al(NO3)3的混合溶液500mL,定容时,俯视刻度线,则所配溶液的浓度__________(填?偏大?或?偏小?)。
(2)配制c(NaOH)=1.6和c(Na2CO3)=0.8mol/L的混合溶液500mL,配制时,若用托盘天平称取NaOH固体,则需称取NaOH的质量为__________;该混合溶液中c(Na+)=__________mol/L。
(3)将(1)和(2)所配溶液混合后,过滤即得水滑石,过滤时玻璃棒的作用是__________。
Ⅱ.水滑石组成的测定
(4)设上述制得的水滑石组成为MgaAlb(OH)c(CO3)d。已知:a+b+c+d=25(a、b、c、d为正整数)。制得的样品含MgaAlb(OH)c(CO3)d0.1mol,用1mol/L的盐酸使其完全溶解,消耗盐酸的体积为1.8L;同时生成2.24L(标准状况)CO2,此时溶液中只含AlCl3和MgCl2两种溶质。通过计算确定该水滑石的化学式(请写出计算过程)。
19.(15分)二氧化氯是一种高效消毒剂,在60℃时用氯酸钾与草酸反应可生成二氧化氯,实验装置如下图所示:
已知:通常状况下二氧化氯沸点为11.0℃,极易爆炸,制取和使用二氧化氯时要用性质稳定的气体稀释,以防爆炸。回答下列问题:
(1)装置A中产物有K2CO3、ClO2和CO2等,写出该反应的化学方程式:__________;装置A中还应安装的玻璃仪器是__________,其作用是__________。
(2)装置B用冰水浴的原因是__________;
(3)实验过程中,装置C的溶液中除了会产生少量Na2CO3外还会生成等物质的量的另外两种钠盐,其中一种为为NaClO2,则另一种钠盐的化学式为__________。
(4)已知NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2.3H2O,在温度高于38℃时析出晶体NaClO2.请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:a.__________;b __________;c.过滤、洗涤;d.干燥.
(5)工业上常用盐酸或双氧水还原氯酸钠制备ClO2,用H2O2制备的ClO2比用盐酸制备的ClO2更适合用于饮用水的消毒,其主要原因是__________。
20.(14分)碳和碳的化合物在生产、生活中有重要作用,甲醇水蒸气重整制氢系统可能发生下列三个反应:
①CH3OH(g) CO(g)+2H2(g) △H1=+90.8kJ/mol
②CH3OH(g)+H2O(g) CO2(g)+3H2(g) △H2=+49kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g)
回答下列问题:
(1)△H3=__________;
(2)根据化学原理分析升高温度对反应②的影响__________;
(3)甲醇使用不当会造成其对水质的污染,用电化学可消除这种污染,其原理是电解CoSO4、稀硫酸和CH3OH混合溶液,将Co2+氧化成Co3+,Co3+再将CH3OH氧化成CO2。
①电解时,阳极的电极反应式为__________;
②Co3+氧化CH3OH的离子方程式为__________。
(4)控制反应条件,反应①中的产物也可以用来合成甲醇和二甲醚,其中合成二甲醚的化学方程式为3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g),在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比[ ]的变化如图所示:
合成二甲醚的最佳氢碳比比为__________,对于气相反应,用某组分(B)的平衡分压(PB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),水煤气合成二甲醚的反应的平衡常数表达式为KP=__________。
(5)在标态(反应物和产物都处于100kPa)和T(K)条件下由稳定单质生成1mol化合物的焓变称为该物质在T(K)时的标准焓,用符号△H?表示。已知石墨和一氧化碳的燃烧热△H分别为-393.5kJ?mol-1和-283.0KJ?mol-1,则CO2(g)、CO(g)的△H?分别为__________、__________。
21.(12分)本题包括A、B 两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.氰化钾是一种由剧毒的物质,贮存和使用时必须注意安全。已知:KCN+H2O2=KOCN+H2O,回答下列问题:
(1)OCN-中所含三种元素的第一电离能从大到小的顺序为__________(用盐酸符号表示,下同),电负性从大到小的顺序为__________,基态氮原子外围电子排布式为__________。
(2)H2O2中的共价键类型为__________(填键?或键?),其中氧原子的杂化轨道类型为__________;分子中4个原子__________(填?在?或?不在?)同一条直线下;H2O2易溶于水除它们都是极性分子外,还因为__________。
(3)与OCN-键合方式相同且互为等电子体的分子为__________(任举一例);在与OCN-互为等电子体的微粒中,由院长元素组成的阴离子是__________。
B.四碘化锡是一种橙红色结晶,熔点为144.5℃,沸点为364℃,不溶于冷水,溶于醇、苯、氯仿等,遇水易水解,常用作分析试剂和有机合成试剂。实验室制备四碘化锡的主要步骤如下:
步骤1:在干燥的圆底烧瓶中加入少量碎锡箔和稍过量的I2,再加入30mL冰醋酸和30mL醋酸酐[(CH3CO)2O]。实验装置如图所示,组装好后用煤气灯加热至沸腾约1-1.5h,至反应完成;
步骤2:冷却结晶,过滤得到四碘化锡粗品;
步骤3:粗品中加入30mL氯仿,水浴加热回流溶解后,趁热过滤;
步骤4:将滤液倒入蒸发皿中,置于通风橱内,待氯仿全部挥发后得到四碘化锡晶体。
回答下列问题:
(1)图中仪器a的名称为__________;冷却水从接口__________(填?b?或?c?)进入。
(2)仪器a上连接装有无水CaCl2的干燥管的目的是__________;锡箔需剪碎的目的是__________;加入醋酸酐的目的是__________。
(3)烧瓶中发生反应的化学方程式为__________;单质碘需过量的主要目的是__________。
(4)反应已到终点的现象是__________。
(5)步骤3和步骤4的目的是__________。
2018届江苏高考化学模拟试卷答案1.D 2.C 3.A 4.C 5.B 6.B 7.A 8.C 9.D 10.D
11.B 12.BC 13.D 14.AC 15.CD
16.(1)+6
(2)将矿石粉碎(或增加空气的进入量或采用逆流原理等);
17.(1)C6H6O2; ;
(2)羰基和醚键;
(3)取代反应;
(4)5; ;
(5)
18.(1)偏大
(2)32,0g;3.2
(3)引流
(4)n(CO32-)=n(CO2)= =0.1mol
d= = =1
n(HCl)=cV=1mol/L?1.8L=1.8mol
c= = =16
根据化合物化合价代数和为0可得2a+3b=18
结合a+b+c+d=25可得a=6,b=2
所以水滑石的化学式为Mg6Al2(OH)16CO3
19.(1)2KClO3+H2C2O4 K2CO3+CO2?+2ClO2?+H2O;温度计;控制水浴加热温度为60℃;
(2)常温下二氧化氯为气态;用冰水将其冷凝为液态,以防爆炸
(3)NaClO3;
(4)蒸发浓缩;低于38℃时冷却结晶;
(5)H2O2作还原剂时氧化产物为O2,而盐酸作还原剂时产生大量Cl2.
20.(1)-41.8kJ/mol
(2)升高温度反应②速率加快,升高温度有利于反应②向正反应方向移动
(3)①Co2+-e-=Co3+;②6Co3++CH3OH+H2O=CO2?+6Co2++6H+;
(4)1.0; ;
(5)-393.5kJ/mol;-110.5kJ/mol
21.A.(1)N>O>C;O>N>C;2s22p3;
(2)?键;sp3;不在;H2O2分子与H2O分子间可形成氢键
(3)CO2(或N2O);N3-
B.(1)冷凝管;b;
(2)防止空气中水蒸气进入反应器中;增大与I2的接触面,加快反应速率;除去体系中的水,防止四碘化锡水解;
(3)Sn+2I2 SnI4;防止锡屑混入四碘化锡晶体中(或使锡反应完全)
(4)紫红色的碘蒸气消失,溶液颜色由紫红色变成橙红色
(5)提纯SnI4产品。
2017年江苏高考作文精选合集三篇
2017年江苏高考总分480分(语数外),其中选修两门按比例划分等级A+、A、B+、B、C、D,不计算分数。
普通高中学生根据校专业选考科目要求,结合自身特长兴趣,首先在物理、历史2门科目中选择 1门,再从思想政治、地理、化学、生物4门科目中选择1门参加考试。以文理科分开进行分数分值解释:
文科生:语文160分+40分(附加)、数学160分、英语120分、选修历史(必选)100分、选修X(自选)100分。
理科生:语文160分、数学160分+40分(附加)、英语120分、选修物理(必选)100分、选修X(自选)100分。
扩展资料2019年4月23日,江苏省人民政府召开“深化普通高校考试招生制度综合改革实施方案”新闻发布会,正式发布江苏2021年高考改革方案。实行“3+1+2”、不分文理、总分750分、使用全国卷模式。
选择性考试科目思想政治、历史、地理、物理、化学、生物6门。学生根据高校的要求结合自身特长兴趣首先在物理、历史2门科目中选择1门再从思想政治、地理、化学、生物4门科目中选择2门考试成绩计入考生总分作为统一高考招生录取的依据。
参加统一高考的学生可以用统一高考的语文、数学、外语科目考试替代相应科目的合格性考试。
百度百科-普通高等学校招生全国统一考试
百度百科-江苏高考新方案
2022年新高考江苏卷各科试卷及参考答案解析汇总
江苏高考作文一: 与车共舞
20世纪初,卡尔·本茨发明了汽车。由三轮到四轮,从无盖到封闭再到敞篷,汽车的功率不断提高,人们“假车马”而“致千里”,世界在人们的脚下变小。人们纷纷赞叹这是一项伟大的发明。
21世纪,汽车成为了人们主要的交通工具,却不再受到那样的赞誉。噪音、尾气污染,越来越多的人放弃了开车出行,转而回归原始,投奔自行车或是双脚。不仅如此,汽车在有些人的眼中更成为了快节奏,城市化生活的祸首,被指责。
不可否认,汽车为带来便捷的同时,也带了快节奏的生活。人们耳边回响着“向前向前”“加速加速”之类的话语,期望一脚油门,一声呼啸就可以快速到达目的地。人们不再耐烦于等待,甚至将孩子们与昆虫最自然的交流看成是浪费时光和虚度年华。
“草在结它的种子,树在摇它的叶子,我们就站着,不说话”,这是诗人顾城的慢节奏生活,而今这样的生活却只存在诗人的精神花园或是上一辈的记忆中。在田野中漫步或者骑行,随时停下采撷脚边的野花,无车的时代人们曾有过这样的惬意生活,而今人们驾着车飞速掠过一片片田野,只见得金黄一片,心中贫瘠而躁动。
那么,我们真的不能与车和谐相处了吗?
也不尽然。一位诗人在千年之前就为我们提供了答案“结庐在人境,而无车马喧。问君何能尔?心远地自偏。”无论何时何地,无论是否周身一片喧嚣,川流不息,只要拥有内心的独立,就能拥有如同顾城或是陶渊明一样的澄澈内心。
当我们身陷阻塞的车流中时,不必再暗自愤恨地咒骂,打开窗,可以看见同样归家的飞鸟写给天空的散文诗,可以看见树叶与晚风最后一次尽情的舞蹈,可以瞥见另一扇车窗后焦急归家的同路人。一切并没有那么着急。不仅如此,车辆并不仅仅将我们载往压抑逼仄的办公室,路途的另一端拥有更多的可能与期待,是郊区枫林的漫山红遍,是异国风情的乐曲舞蹈,是远方姑娘的纯净的笑容……
木心先生说:“从前的日色变得慢,车、马、邮件都慢,一生只够爱一个人。”现在的车马都快了起来,风驰电掣,而日色依旧缓慢,一生依然可以只爱一个人。
与车共舞,一样有璀璨人生。
江苏高考作文二: 车里车外
淅沥沥的雨肆意地下着,我在车里,雨在车外。
人人都爱车,远行、踏青离不开车。外出,有车就有安全感,天亮天黑,都会被车挡在外面,为我们创造的是暖暖灯光和适宜的温度。晚间,将要回家的时候,按下手里的钥匙,车灯便开始远迎,像侍卫,将要带我安全离开,无论什么样的环境,车都会帮助我们应对。有言云之:有灯就有人,我说:有车就有人。
车里,是奋进的人生。
当方向盘确定了角度,目的地也就近在咫尺,车里的种种操作按钮就是我们的种种动力,每一件都至关重要,速度控制着时间,引擎牵引着整个车身,坐在车里的我们,集中所有的注意力,开往未来,开往理想,不由得这就是我们每天的状态,油加满,调整好状态便可以开启一天的生活。开车意味着前进,开车的状态就是生活的状态。
有时我们要慢慢地开,因为路况、因为人群,放慢速度是一种智慧,根据情况调整速度和方向帮助我们安全通过艰难路段,很多人喜欢快速地前行,而我总喜欢按部就班慢慢地开,车速能够随着自己的意志调控才有安全感,有人说:车品即人品,性格决定了这个人开车的习惯,这也有几分道理,一个保守的人开车一定也很保守,有些外向性格的人总是喜欢超车和变道。
有时开快车也可见水准,当我们成群结队出去旅行,想不因技术原因掉队,也必须开快车。或许总有需要我们打破常规的时候,生活不会千篇一律,应变十分重要,到了加速的时候也必须超越自己。
车外,是风景,是人群。
车外的环境就像生活的外因,不在控制以内,车里的我们要根据车外来决定车里。车外有风雨,车外有阻碍,如果一段路正在检修,我们就必须绕行,就像很多时候生活中,我们也要学会绕行,没有一条直路可以到达目的地,必须转弯,一个又一个弯组成了我们的经历我们的路,“绕行”规避了风险,找到了捷径。
车外熙熙攘攘的人群,你来我往,有的成为了朋友,有的只是一面之缘。而作为行者,我们不可以停下,总要牢牢抓好我们的方向盘,注视前方,去追寻一种远方。
车里的自己,车外的他人。
车里的奋进,车外的人群。
车里的自律,车外的自由。
每一步都认真走过。
江苏高考作文三: 民族的灵魂
古往今来,历史的车轮如狂风般呼啸而过,卷起的风沙曾湮灭多少辉煌?!然而,一直有一群人昂首在天地之间!他们是历史的弄潮者,他们永远忠于自己民族的灵魂,他们称自己为:中国人。
《周易》有云:"天行健,君子以自强不息。"诚然,这是中华民族自古便有的民族精神,它作为一代又一代人的精神支柱,屹立千年,以至于时至今日,这种不畏艰险勇往直前的精神仍深埋在我们民族的灵魂之中。
灵魂是不可弃的。若连灵魂都可以遗弃,又谈何精神?又谈何民族?然而,中华民族历却又不乏丢失灵魂的时候。君可记得曾经的丧权辱国?这都是我们曾经的"落魄"。但君又可记得虎门上空熊熊的热浪?君又可知晓粉碎四人帮时的举国欢庆?没错,中国人一直未曾忘记他们民族的灵魂!那是他们永恒的,不屈的精神!
"必须敢于正视,这才可望,敢想,敢说,敢做,敢当。"这是鲁迅对曾经的中国人的告诫。而这句话又是否适用于现代中国人?我们中不乏缺少民族精神的人,没有上进心,崇洋媚外,民族歧视者怕是大有人在。然而人们总以一种抱怨教育、抱怨社会、抱怨国家的心态回避问题,而不是从自身调整。而那些问题也并未有所解决。我们是不是该反省,我们是不是错了?我们是不是已经丢失了民族的灵魂?我们是不是应该正视这"惨淡的人生"?!
中华民族的灵魂是坚定不移的磐石,是勇往直前的激流,是不朽不折的古树,是昂首挺胸的雄狮!
中国人可能不是最伟大的民族,但中国人绝对是不向任何人低头的民族!所有的辉煌我们都记着,所有的屈辱我们也记着。因为我们知道,这辉煌是所有屈辱的血泪支撑起来的!我们要让所有的后代都知道,中国人面对屈辱并没有妥协,而是在忍辱中丰满羽翼,等待崛起后的一飞冲天!
正如毛主席所说:"数风流人物,还看今朝!"长江后浪推前浪,一浪更比一浪强!我们不能遗忘曾经,我们要铭记历史,铭记所有的屈辱与辉煌,更要铭记那永垂不朽的民族的灵魂!
高考结束后,最令考生关注的便是2022年高考成绩,只有知道高考成绩才能够对接下来的志愿填报充满信心。本期我便为大家带来2022年江苏卷高考答案及试卷解析汇总,希望这份江苏卷高考答案及试卷解析能够帮助到各位。
一、2022年高考江苏卷答案及试卷解析汇总(完整版)
同学们如果想要知道自己考试成绩所对应的大学院校,可以点击文章开头或末尾处的“输入分数,看能上的大学”,进行查看!
江苏卷适用地区:江苏。
1、2022年江苏卷语文试卷及参考答案解析
(点击查看)
2、2022年江苏卷数学试卷及参考答案解析
(点击查看)
3、2022年江苏卷英语试卷及参考答案解析
(点击查看)
4、2022年江苏卷物理试卷及参考答案解析
(点击查看)
5、2022年江苏卷化学试卷及参考答案解析
(点击查看)
6、2022年江苏卷生物试卷及参考答案解析
(点击查看)
7、2022年江苏卷政治试卷及参考答案解析
(点击查看)
8、2022年江苏卷历史试卷及参考答案解析
(点击查看)
9、2022年江苏卷地理试卷及参考答案解析
(点击查看)
二、志愿填报热门参考文章
江苏本科分数线2022最低分数多少?附预估江苏2022年高考分数线
2022年江苏高考全省位次查询-江苏位次对照表2021
各大学在江苏录取位次排名2021-各大学在江苏录取分数线2021
上一篇:江苏去年高考卷_江苏高考考卷